tema 1- Materiais
Materiais em laboratório:
1- Gobelé 9- Balão Erlenmeyer 17- Suporte universal 25- Espátula
2- Tina 10- Tubo de ensaio 18- Filtro 26- Balança
3- Vidro de relógio 11- Balão de fundo chato 19- Tripé 27- Pompete
4- Provetas 12- Funil 20- Lamparina 28- Garrafa de esguicho
5- Balão volumétrico 13- Bureta 21- Rolhas 29- Óculos e luvas
6- Termómetro 14- Funil de decantação 22- Pinças metálicas 30- Almofariz e pilão
7- Colher de combustão 15- Funil de Buchner 23- Pinça de madeira 31- Cápsula de porcelana
8- Pipeta 16- Kitasato 24- Tesoura 32- Reagentes (álcool étilico, álcool cloridrico, hidróxido de sódio)
Classificação dos materiais:
Podem distinguir-se três tipos diferentes de materiais:
Materiais naturais que são os materiais que se obtêm diretamente da Natureza. Ex.: areia, água, algodão, carvão.
Os materiais naturais podem distinguir-se de acordo com a sua origem: animal, vegetal e mineral.
Materiais naturais manufacturados- que são os materiais naturais trabalhados pelo homem. Ex.: borracha natural, aço, papel, madeira, barro, vidro.
Materiais sintéticos que são os materiais fabricados pelo homem em laboratório ou na indústria. Ex.: fio de pesca (nylon), plástico, tinta, esponjas sintéticas, poliéster, borracha sintética, verniz.
Quanto à sua composição:
Substâncias puras (materiais formados por um só componente)- apresentam o mesmo aspeto e as mesmas propriedades em toda a sua extensão.
Misturas (materiais formados por dois ou mais componentes)- são formados por substâncias que apresentam diferentes propriedades.
Quanto ao seu aspeto:
Misturas homogéneas são misturas com aspeto uniforme, nas quais não é possível distinguir os seus constituintes por simples observação direta ou mesmo usando um microscópio comum. Ex.: ar que respiramos, vinho ou sal das cozinhas.
Misturas heterogéneas são misturas nas quais é possível distinguir dois ou mais constitiuntes diferentes. Ex.: areia da praia, granito ou iogurte com pedaços.
Misturas coloidais são materiais que embora apresentem aspeto homogéneo a olho nu, é possível distinguir-se alguns constituintes numa observação microscópia cuidadosa. Ex.: leite, manteiga, tintas ou sangue.
Soluções
As soluções são misturas homogéneas de duas ou mais substâncias e podem apresentar-se nos três estados físicos da matéria- sólido, líquido e gasoso. Uma solução é constituída, no mínimo, por dois materiais.
Soluto é substância que é dissolvida no líquido. No caso de se tratar de dois líquidos, é o material que estiver em menor quantidade.
Solvente é a substância que dissolve o soluto.
Soluções aquosas são aquelas em que o solvente é a água. Ex.: água salgada ou chá açucarado.
Soluções alcoólicas são aquelas em que o solvente é o álcool. Ex.: perfumes, after-shaves ou desodorizantes.
A solubilidade é a quantidade máxima de soluto que é possível dissolver numa unidade de volume de solvente a uma dada temperatura.
Uma solução diz-se saturada, a uma certa temperatura, quando não é possível solubilizar mais quantidade de soluto num dado volume de solvente.
Concentração mássica
A concentração mássica é uma medida da massa de soluto dissolvido numa unidade de volume de solução.
A expressão que traduz a relação entre eles é:
concentração mássica=
Propriedades físicas e químicas das substâncias
Propriedades físicas dos materiais
Um dos processos utilizados para caracterizar uma certa substância é recorrer à determinação de três propriedades físicas que são específicas para cada substância: ponto de fusão, ponto de ebulição e massa volúmica.
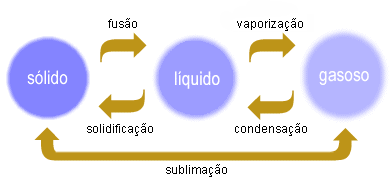
Ponto de fusão é a temperatura à qual a substância passa do estado sólido ao estado líquido a uma dada pressão. Cada substância pura tem um ponto de fusão próprio.
Durante a fusão de uma substância pura, a temperatura mantém-se constante.
Ponto de ebulição é a temperatura à qual a substância passa, tumultuosamente, do estado líquido ao estado gasoso, a uma dada pressão. Cada substância pura tem um ponto de ebulisão próprio.
Durante a ebulisão de uma substância pura, a temperatura mantém-se constante.
Massa volúmica é uma grandeza que relaciona a massa de um material com o seu volume, a uma dada temperatura.
A expressão matemática que traduz essa relação é dada por:
=
Separação dos componentes de uma mistura
Para separar os componentes de uma mistura podem usar-se diversas técnicas que permitem obter os materiais que inicialmente foram juntos, mantendo as suas propriedades específicas.
Processos de separação de misturas heterogéneas
Sólidos misturados num líquido
Para cada mistura existe um ou várias processas físicos capazes de a decompor em substâncias ou em misturas menos complexas.
Decantação- É um processo físico que permite separar materiais sólidos depositados no fundo do recipiente que contém uma solução ou um liquido. A separação realiza-se transferindo cuidadosamente o líquido de um recipiente para outro com a ajuda de uma vareta.
Filtração- É um processo que permite separar partículas sólidas em suspensão num líquido ou numa solução, recorrendo à utilização de um papel de filtro que retém o sólido, que toma então o nome de redíduo. A solução que atravessa os poros do papel de filtro designa-se filtrado.
Centrifugação- Este processo permite separar de forma eficaz materiais suspensos num líquido. Quando este é submetidoao rápido movimento de rotação de uma centrifugadora, projeta os materiais em suspensão para o fundo devido à ação de uma força centrífuga. O líquido é depois retirado por decantação, enquanto o resíduo sólido fica depositado.
Sólidos misturados com outros sólidos
Peneiração- Processo físico que permite separar materiais sólidos de diferentes tamanhos, utilizando uma rede de malha que permite reter as partículas de maiores dimensões, deixando passar as partículas menores. Ex.: peneirar a farinha do feijão ou do arroz.
Separação magnética- Processo utilizado quando um dos componentes da mistura apresenta propriedades magnéticas, ou seja, é atraído por um íman. Ex.: separação do pó de ferro de uma mistura de ferro e enxonfre.
Sublimação- Processo utilizado quando uma das substâncias da mistura de sólidos passa diretamente do estado sólido, ao gasoso, ou seja, sofre sublimação. Ex.: sublimação do iodo de uma mistura de iodo e areia.
Dissolução fracionada- Processo utilizado quando um dos componentes sólidos é solúvel num determinado solvente e os outros não. Ex.: separação do sal da areia por dissolução com água.
Líquidação misturados com outros líquidos
Decantação em funil- É um processo que permite separar dois ou mais líquidos de diferentes densidades e imiscíveis utilizando um funil de decantação. O líquido mais denso deposita-se no fundo do funil e é portanto o primeiro a ser recolhido por outro recipiente. O mesmo procedimento é usado para a separação dos restantes líquidos. Ex.: separação do azeite do vinagre.
Processos de separação de misturas homogéneas
Cristalização- Processo que permite separar um sólido dissolvido num líquido. Devido à evaporação lenta do solvente, ocorre a formação de cristais (sólido cristalino). Ex.: evaporação lenta de uma solução de sulfato de cobre com formação de cristais.
Destilação- Separa o solvente pela ebulição seguida de condensação dos vapores formados. Ex.: destilação simples do vinho e destilação do petróleo.
Cromatografia- Processo que permite separar os diferentes componentes de uma mistura homogénea recorrendo à diferente capacidadede de absorção das diferentes substâncias que compõem a mistura. Isto permite observar que substâncias diferentes são arrastadas com diferentes velocidades por certos solventes ao longo de um material poroso. Ex.: separação dos diferentes componentes da tinta de um marcador.
Transformações físicas e transformações químicas
Transformações físicas
Caracterizam-se pela alteração no aspeto ou no estado físico do material, mas sem que se verifique alteração na sua constituição, não havendo por isso formação de novas substâncias. São disso exemplo as mudanças de estado físico da matéria. Ex.: mudança do estado sólido ao estado líquido.
massa de soluto
volume da solução
massa
volume